目次
電気陰性度とは
電気陰性度とは…
原子が共有電子対を引っぱる強さ。周期表の右上ほど値が大きい(引っぱる力が強い)。
さて、ここからどんな事が言えるでしょうか。フッ化水素(HF)と水素分子(H2)を例に考えてみましょう。
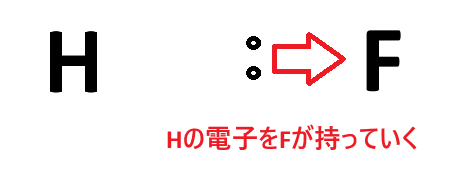
例① フッ化水素(HF)
水素(H)とフッ素(F)ではフッ素の方が電気陰性度が大きいので、共有電子対はフッ素の方に引き付けられます。水素は自分の電子を持っていかれたので+電荷をもち、フッ素は水素から電子をもらったので -電荷をもつことになります。
このような電荷の偏りを「極性」と言います。
次は水素分子です。
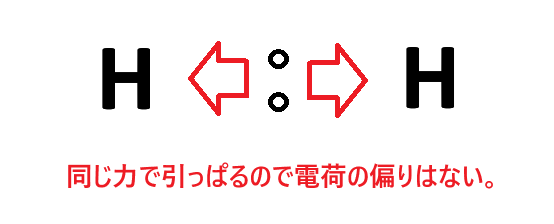
例② 水素分子(H2)
2つの水素はもちろん電気陰性度が同じなので、共有電子対は同じ力で引っぱられます。そうすると共有電子対はどちらに偏ることもなく、丁度ど真ん中にいることになります。したがって2つの水素原子の電荷は±0です。
このとき「極性はない=無極性」と言います。
電気陰性度を持たない原子
電気陰性度には例外となる原子があります。それは貴ガスです。
電気陰性度の定義は「共有電子対を引っぱる強さ」でした。しかし、貴ガスは閉殻構造で安定なため、他の原子と結合を作りません。すなわち共有電子対を持つことがないのです。
なので原則的に貴ガスは電気陰性度の値を持ちません。
今回は以上です。分からないことがあればコメントから質問してください。

コメント