「酸化=酸素化=酸素をもらうこと」というのが酸化の元々の定義でした。
では、なぜ電子を失うことも「酸化」と言えるのでしょうか。
見ていきましょう。
結局のところ、電気陰性度
今回も結論は、電気陰性度です。知識が怪しい人は次の記事が参考になります。
1-1 電気陰性度とは何ですか。
4-1 単体の酸化数が0になる理由を教えてください。
例を使って考えてみる
例えば次の反応を考えましょう。
2Cu + O2 → 2CuO
銅(Cu)が酸素をもらっているので、これはれっきとした酸化反応ですね。
ここでCu-Oの共有結合に注目してみましょう(Cu-Oはイオン結合とされていますが一旦無視します)。
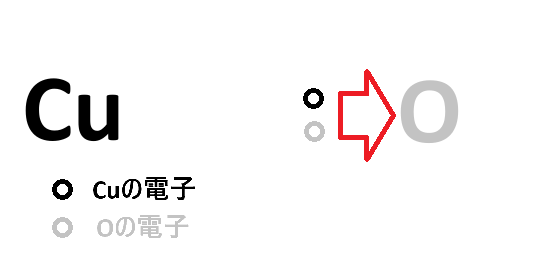
CuとOではOの方が電気陰性度が大きいので、共有電子対はO側に引っぱられます。これをすごく極端に言えば、
「Cuの電子はOに奪われた=Cuは電子を失った」と言えそうです。
そしてなんと、ここで思い切って、酸化の定義を「電子を失うこと」としてしまいました!昔の人が!
ただ、こう定義するととっても便利で、次のような酸素が出てこない反応も「酸化」と言うことができます。
Mg +Cl2 → MgCl2
MgとClではClの方が電気陰性度が大きいので、Mgの電子はClに奪われることになり、「Mgは酸化された」と言えるわけです。
結論
「なぜ電子を失うことが酸化と言えるのか」。結論をまとめます。
①本来「酸化」とは「酸素と化合すること」でした。
②ただ、酸素(O)の電気陰性度は非常に大きいため「酸素と化合すること=電子を失うこと」と言い換えることができます。
③つまり、「酸化=電子を失うこと」となります。
そしてこの定義を使うことで、酸素が出てこない反応についても酸化還元反応として分析ができるようになりました。化学の世界が広がったということですね。
今回は以上です。分からないことがあればコメントで質問してください。

コメント