大学受験に限って言えば、酸化数を求める系の問題は公式を覚えていれば何の問題もありません。なのでこれから書くことは気になる人だけ読んでもらえれば大丈夫です。
ここでは「単体の酸化数が0になる理由」だけでなく、「化合物の酸化数」についてもついでに解説しちゃいましょう。
酸化数とは何か
酸化数とは、原子が電子を「いくつ余分に持っているか」 または 「いくつ失っているか」を表す指標です。
たとえば、水素原子(H)が電子を1個失って水素イオン(H+)になると酸化数は「+1」と考えます。逆に電子を1個もらって水素陰イオン(H–)となった場合は酸化数は「-1」と考えます。(水素陰イオンは高校化学では出てこないですが、理論上考えることは可能です。)
次は電気陰性度の復習をしましょう。
電気陰性度とは
いきなり電気陰性度の話が出てきて「何のつもりだ!」と思う人もいるかも知れませんが、電気陰性度がとっても大事なんです。ということで知識が怪しい人は下のリンクで復習しましょう。(分かっている人は飛ばしてください)
単体の酸化数が0になる理由
単体の酸化数が0になる理由。もう簡単ですね。
単体は同じ原子同士が結合したものなので、電子の偏りは全くありません。つまり、「電子を余分に持っていたり、失っていたりしない=酸化数が0」ということです。
化合物の酸化数を考えてみよう
さらに応用して化合物中の原子の酸化数を考えることができます。水(H2O)を例に考えてみましょう。
まずは公式の確認。
・化合物中の水素原子の酸化数は「+1」
・化合物中の酸素原子の酸化数は「-2」
これを電気陰性度から説明してみましょう。水素(H)と酸素(O)では酸素の方が電気陰性度が大きいため、共有電子対は酸素側に引っぱられています。
水素は自分の電子1個を酸素側に持っていかれているので、酸化数は「+1」となります。
酸素は2つの水素から電子を1個ずつもらっているので、酸化数は「-2」となります。
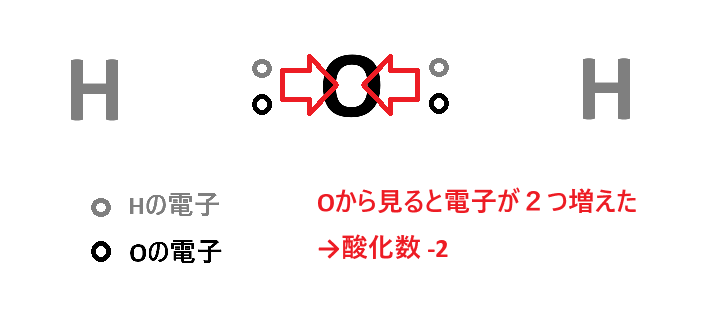
他の化合物も同じように酸化数を求めることができます。ぜひやってみてください。
分からなくなったらコメントで質問してください。
今回は以上です。お疲れさまでした。

コメント